こんにちは、蒼い小鳥です
薬剤師になって数年経ち、今は管理薬剤師をやっています
前回の内容は反応速度の反応次数と反応速度定数の基本をしました
今回はその発展内容をやっていきます
では、頑張っていきましょう
0~2次反応のグラフを合わせたときのグラフ

前回式を作ったときに分かったと思います
では今回は0~2次反応のグラフを合われてみましょう
反応速度は0次の場合濃度に無関係、1次反応の場合濃度に比例、2次反応の場合濃度の2乗に比例
また半減期は0次の場合初濃度に比例、1次反応の場合初濃度に無関係、2次反応の場合初濃度に反比例
これらを念頭に入れて、分解率と残存率のグラフを見てみましょう
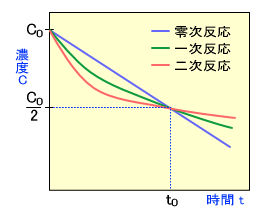
グラフはこのようになり、t0はt1/2のことです
これを見ると半減期t1/2に到達するまでは0次反応のほうが残存率が高く、半減期t1/2より時間がたってしまうと残存率は2次反応のほうが残存率が高くなります
問題を解いてみましょう
問題例1
化合物A、B及びCの分解過程はみかけ上、0次反応、1次反応、又は2次
反応のいずれかで起こっている。図は3つの化合物の初濃度が10mg/mLのと
きの、化合物濃度の経時変化を示しており、いずれの場合も半減期は4hであっ
た。この初濃度を20mg/mLに変えたとき、A、B及びCの半減期は、それぞれ(a)h、(b)h及び(c)hである。()に入れるべき数値の正しい組合せはどれか。95回問23
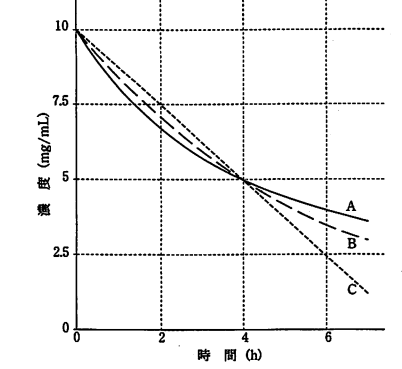
まず、A,B,Cがそれぞれ何次反応か考える。そうすると、Aは2次、Bは1次、Cは0次だと分かります
上の図から1次反応は初濃度に関わらずに一定に半減するため、bは4だと分かります
次に、0次反応は初濃度に比例して下がるため、初濃度が10→20と2倍になったので、時間も2倍になるので\(4×2=8\)となりCは8だと分かります
最後に、2次反応は初濃度に反比例するので、\(4÷2=2\)となり、Aは2だと分かります
よって今回の答えは3です
懸濁剤の分解反応

次は、懸濁剤の分解反応についてです
懸濁剤は、溶液内の薬剤濃度が飽和状態と固体の薬剤が状態が混在しているところから始まることを理解していれば分かりやすいと思います
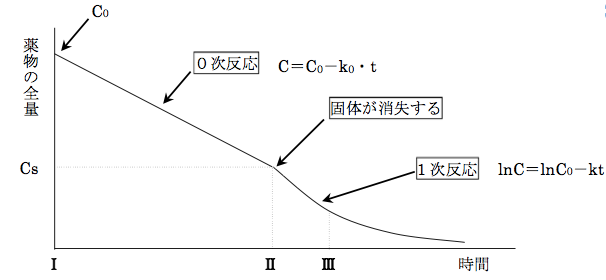
この図を使用して説明すると、時間軸のⅠ~Ⅱの間には固体の薬剤が存在します
Ⅱ(時間)になると固体の薬剤はなくなり、時間が経つと飽和した状態から少しずつ濃度が減っていきます
このように固体が存在する溶液から固体がなくなり、溶液の濃度が減っていく反応を擬0次反応と言われています
個体が消失するまでが0次反応で消失後は1次反応になるため、Ⅱのタイミングは0次反応の反応速度と1次反応の反応速度が同じになるためこのような計算ができます
0次反応の反応速度は\(\frac{dC}{dt}=k・C ^ n \)より\(\frac{dC}{dt}=k0\)
1次反応の反応速度は\(\frac{dC}{dt}=k・C ^ n \)より\(\frac{dC}{dt}=k1・C\)
これにより
\(k0=k1・C\)
(knのnは0次反応と1次反応を見分けるため)
問題を解いてみましょう
問題例2
ある薬物Aの水に対する溶解度は 5w/v%であり、1次反応速度式に従って分
解し、その分解速度定数は 0.02h-1である。この薬物 1.5g を水 10mLに懸濁さ
せたとき、残存率が 90%になる時間(h)に最も近い値はどれか。 1つ選べ。ただ
し、溶解速度は分解速度に比べて十分に速いものとする。
(1) 2.5 (2) 7.5 (3) 13.5 (4) 15 (5) 75
まずこの問題は、薬物濃度の何w/v%であるかを計算してみます
1.5g / 10mL であるため、単位変換すると15g / 100mL=15w/v%だと分かります
また、この問題では溶液が飽和するタイミングが5w/v%であることが分かっているので0次反応式の分解速度定数を出します
k0=k1・Cを使用し、k0=0.02h-1・5w/v%=0.10w/v%だと分かります
次に残存率が90%になる時間なので15w/v%・0.9=13.5w/v%
0次反応式は$C=C₀-kt$なので
13.5w/v%=15w/v%-0.10h-1・t
t=15h
よって答えは4です
まとめ

今回は0~2次反応の分解率と残存率をグラフで見たときの問題と擬0次反応の問題について行いました
0~2次反応の分解率と残存率をグラフ
初濃度が同じで半減期が同じグラフを取るときは
- 半減期前は残存率が0次>1次>2次になり、分解率は2次>1次>0次になります
- 半減期後は残存率が2次>1次>0次になり、分解率は0次>1次>2次になります
擬0次反応
懸濁剤の問題としてよく出てくる計算です
固体が残っていて飽和濃度になっている時、固体が消失した時、固体の消失後で使う式が変わります
- 固体が残っていて飽和濃度になっている時は0次反応の式を使って計算
- 固体が消失したときは0次と1次の反応速度が同じになるのでk0=k1・Cを使って計算
- 固体の消失後は1次反応の式を使って計算



コメント